
Εικόνα από τον McCall Sarrett
Είτε ξεχνάτε 20 χρόνια από τη ζωή σας είτε κάνετε την ίδια συνομιλία κάθε πέντε λεπτά για να την ξεχνάτε κάθε φορά, η εξασθένηση της μνήμης μπορεί να έχει μεγάλο αντίκτυπο στην καθημερινή ζωή. Μπορεί να είναι μια από τις πιο συγκεχυμένες πτυχές του νευροεκφυλισμού και είναι ένα βασικό σύμπτωμα της άνοιας.
Η ασθένεια Αλτσχάϊμερ, γνωστός και ως AD, είναι η πιο κοινή μορφή άνοιας, που χαρακτηρίζεται από γνωστικές δυσκολίες και απώλεια μνήμης. Επί του παρόντος δεν υπάρχει επίσημη κλινική τεχνική για τη διάγνωση της AD, εκτός από την αυτοψία. Ωστόσο, υπάρχουν δύο χαρακτηριστικά γνωρίσματα του εγκεφαλικού ιστού ασθενών με νόσο Αλτσχάιμερ: αμυλοειδές βήτα (A?) πλάκες και νευροϊνιδιακά μπερδέματα, τα οποία και τα δύο έχουν παράσχει μια σημαντική εικόνα για την παθολογία του νευροεκφυλισμού.
«Τα νευροϊνίδια προκύπτουν από ένα ελάττωμα στις πρωτεΐνες που ονομάζονται πρωτεΐνες tau».
A? is a protein that results from πρωτεόλυση of Πρόδρομη πρωτεΐνη αμυλοειδούς (APP). This means that APP is cut into smaller fragments, one of which is the A? fragment. APP is cut into these pieces by enzymes called secretases, whose primary role is to cleave these proteins. Various secretases exist, but there is one that is significant for Alzheimer’s pathology – gamma secretase. Gamma secretase produces a special form of A?: A?-42, the most toxic form of the protein. Once broken up, these protein fragments begin to gather in the space outside of the cells. The key to the toxicity of these proteins is that they are characteristically “sticky”, so they begin to form aggregates. These aggregates continue to develop, and soon these amyloid beta plaques are everywhere, greatly impairing neuronal function.
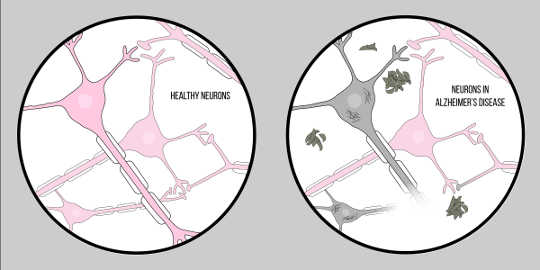 Φιγούρα του McCall Sarrett
Φιγούρα του McCall Sarrett
This impact of A? on neurological function has led to the Υπόθεση αμυλοειδούς, μια καλά αναγνωρισμένη θεωρία που προτείνει μια εξήγηση για τον νευροεκφυλισμό στο Αλτσχάιμερ.
Τώρα, για το δεύτερο βασικό χαρακτηριστικό: νευροϊνιδικά μπερδέματα. Τα νευροϊνίδια προκύπτουν από ένα ελάττωμα στις πρωτεΐνες που ονομάζονται πρωτεΐνες tau. Οι πρωτεΐνες Tau χρησιμεύουν ως γέφυρα μεταξύ των δομών που ονομάζονται μικροσωληνίσκοι μέσα στο κύτταρο. Οι μικροσωληνίσκοι είναι υποστηρικτικά μόρια που παρέχουν σχήμα και δομή στα κύτταρα, συγκεκριμένα στους άξονες. Οι πρωτεΐνες Tau βοηθούν αυτούς τους μικροσωληνίσκους να παρέχουν δομή στους άξονες. Ωστόσο, στην περίπτωση του Της νόσου του AlzheimerΜια νευροεκφυλιστική ασθένεια που χαρακτηρίζεται από απώλεια νευρώνων, οι πρωτεΐνες tau διαχωρίζονται και συσσωρεύονται στο κυτταρικό σώμα, αλλιώς γνωστό ως σώμα. Αυτό προκαλεί εκφυλισμό των αξόνων, καθιστώντας ακόμη πιο δύσκολη την επικοινωνία των νευρώνων. Αυτή η δυσκολία στη νευρωνική επικοινωνία είναι παρόμοια με τις επιδράσεις του αμυλοειδούς βήτα. Ωστόσο, είναι σημαντικό να σημειωθεί ότι αυτά τα μπερδέματα διαφέρουν πολύ από τις πλάκες που συζητήθηκαν προηγουμένως στο ότι επηρεάζουν την επικοινωνία από το εσωτερικό του κυττάρου σε αντίθεση με το εξωτερικό.
«Οι επιστήμονες δεν είναι ακόμα σίγουροι για τον ακριβή μηχανισμό που ευθύνεται για την παθολογία του Αλτσχάιμερ».
Though both are extremely influential, A? and tau are not the only relevant factors when it comes to the pathology of Alzheimer’s. Studies have suggested that the Apolipoprotein E (APOE) γονίδιο may be as influential as A?. There are three major variants that encode for proteins: ApoE2, ApoE3, and ApoE4. ApoE4 has been shown to correlate with a decrease in synaptic pruning, while ApoE2 results in an increase. Both forms influence αστροκύτταρα (σπουδαίος νευρογλοιακά κύτταρα εντός του νευρικού συστήματος) και συσχετίζονται με το ρυθμό φαγοκυττάρωσής τους, τη διαδικασία με την οποία οι αστροκύτταραΓλοιακά κύτταρα σε σχήμα αστεριού που έχουν μια σειρά από λειτουργίες, μεταξύ των οποίων... καταβροχθίζουν το κυτταρικό υλικό. Κάθε παραλλαγή ApoE επηρεάζει άμεσα αυτόν τον ρυθμό φαγοκυττάρωσης, το ApoE2, με αποτέλεσμα μια αύξηση, και το ApoE4, μια μείωση. Αυτό υποδηλώνει ότι τα αστροκύτταρα μπορεί να είναι λιγότερο ικανά να «καθαρίσουν» τα συντρίμμια που επιπλέουν γύρω στο κύτταρο όταν συσχετίζονται με το ApoE4. Έτσι, όταν αυτές οι πλάκες συσσωρεύονται, ο γονότυπος ApoE4 μπορεί να εμποδίσει την κάθαρση αυτών των συσσωματωμάτων, συμβάλλοντας στον εκφυλισμό.
Το αμυλοειδές βήτα, ταυ και διάφορα γονίδια συνεργάζονται για να προκαλέσουν ένα σημαντικό πρόβλημα επικοινωνίας μεταξύ των κυττάρων, που είναι ουσιαστικά η ασθένεια που γνωρίζουμε ως Αλτσχάιμερ. Αυτός ο νευροεκφυλισμός είναι πιο συνηθισμένος σε περιοχές του εγκεφάλου που σχετίζονται με τη μάθηση και τη μνήμη, αλλά τελικά εξαπλώνεται σε ολόκληρο τον εγκέφαλο. Με αυτή την έλλειψη επικοινωνίας έρχεται η απώλεια των συνάψεων, και τελικά, η μείωση της εγκεφαλικής ύλης. Έτσι, είναι φυσιολογικό να βλέπουμε μειωμένο εγκεφαλικό ιστό σε ένα MRIΑπεικόνιση μαγνητικού συντονισμού, μια τεχνική για την προβολή του στρ... καθώς εξελίσσεται η ασθένεια, αποκαλύπτοντας ότι το Αλτσχάιμερ κυριολεκτικά συρρικνώνει τον εγκέφαλο. Τα τρέχοντα μοντέλα μας μάθησης και μνήμης αναφέρουν ότι οι συνάψεις παίζουν βασικό ρόλο σε αυτές τις διαδικασίες, παρέχοντας μια πιθανή εξήγηση για το πώς αυτή η παθολογία συσχετίζεται με τα κύρια συμπτώματα της AD, όπως η απώλεια μνήμης.
Οι επιστήμονες δεν είναι ακόμη σίγουροι για τον ακριβή μηχανισμό που ευθύνεται για την παθολογία του Αλτσχάιμερ. Πολλές καινοτόμες μέθοδοι έχουν ερευνηθεί σε μια προσπάθεια να αποκτηθεί περαιτέρω γνώση αυτού του παθολογικού σημείου, μια από τις οποίες είναι οι βιοδείκτες εγκεφαλονωτιαίου υγρού (ΕΝΥ).
Levels of A? and tau can be measured in CSF through a procedure called a lumbar puncture, which collects cerebrospinal fluid. Increased levels of tau and reduced levels of A? are seen in patients with Alzheimer’s Disease. This is a result of the A? accumulations in the brain, which in turn results in a decreased concentration in the CSF. This data suggests that, in the future, doctors and scientists may be able to predict the cognitive state of a patient by examining protein levels in the CSF.
Επί του παρόντος, δεν υπάρχει οριστική θεραπεία για τη νόσο του Αλτσχάιμερ. Ωστόσο, η αυξανόμενη γνώση των εμπλεκόμενων παθολογικών πρωτεϊνών, τα σχετικά γονίδια και η συνεχιζόμενη επιστημονική έρευνα παρέχουν ελπίδα για μια αποτελεσματική θεραπεία στο μέλλον.
Ποια σημαντική ανακάλυψη πιστεύετε ότι χρειάζεται για την ιατρική για την επίτευξη θεραπείας για τη νόσο του Αλτσχάιμερ; Ενημερώστε μας στα σχόλια!
Αυτό το άρθρο αρχικά εμφανίστηκε Γνωρίζοντας τους νευρώνες?
Σχετικά με το Συγγραφέας
Η Khayla Black είναι πρωτοετής στο Πανεπιστήμιο της Νέας Υόρκης της Σαγκάης που σχεδιάζει να δηλώσει πτυχίο στις Νευροεπιστήμες με δευτερεύον στην Επιστήμη Δεδομένων με συγκέντρωση στην τεχνητή νοημοσύνη. Στο μέλλον, ελπίζει να αποκτήσει MD/PhD και να γίνει νευροεπιστήμονας μελετώντας τις μοριακές πτυχές της μάθησης και της μνήμης. Κατά τη διάρκεια του ελεύθερου χρόνου της, η Khayla απολαμβάνει να εργάζεται με την πρωτοβουλία MYELIN στο IYNA καθώς και να διαβάζει οποιοδήποτε υλικό που σχετίζεται με τις νευροεπιστήμες. Εκτός από τις σπουδές νευροεπιστήμης, της αρέσει να τρέχει, να διδάσκει σε τοπικά δημοτικά σχολεία, να λύνει μαθηματικά προβλήματα και να πίνει τεράστιες ποσότητες καφέ.
Σχετικά βιβλία
at InnerSelf Market και Amazon
αναφορές
Lacor, P. N., Buniel, M. C., Furlow, P. W., Clemente, A. S., Velasco, P. T., Wood, M., . . . Klein, W. L. (2007, January 24). A? Oligomer-Induced Aberrations in Synapse Η σύνθεση, το σχήμα και η πυκνότητα παρέχουν μια μοριακή βάση για την απώλεια συνδεσιμότητας στη νόσο του Αλτσχάιμερ. Ανακτώνται από http://www.jneurosci.org/content/27/4/796
Murphy, M. P., & LeVine, H. (2010). Alzheimer’s Disease and the ?-Amyloid Peptide. Journal of Alzheimer’s Disease?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ, & Wong, PC (2011). Επεξεργασία πρόδρομης πρωτεΐνης αμυλοειδούς και νόσος Alzheimer. Ετήσια επισκόπηση της νευροεπιστήμης, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD, … Barres, BA (2016). Νέος εξαρτώμενος από αλληλόμορφο ρόλος για το APOE στον έλεγχο του ποσοστού συνάψεωνΣυνδέσεις μεταξύ νευρώνων όπου μεταδίδεται σήμα από το... κλάδεμα από αστροκύτταρα. Πρακτικά της Εθνικής Ακαδημίας Επιστημών των Ηνωμένων Πολιτειών της Αμερικής, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, August 19). Amyloid ? and APP as biomarkers for Alzheimer’s disease. Retrieved from https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























